Enzymen zijn essentieel voor het goed functioneren van alle levende organismen op aarde. Ze nemen deel aan de meeste, zo niet alle, chemische transformaties in de natuur, dat wil zeggen aan miljoenen reacties in zowel de plantenwereld als de dierenwereld. Het is de moeite waard om uit te zoeken wat enzymen zijn, hoe ze werken en wat hun betekenis is voor de moderne geneeskunde.
Inhoudsopgave
- Enzymen: structuur
- Regulatie van enzymactiviteit
- Enzymen: rol
- Enzymen: nomenclatuur
- Enzymen en medicijnen
- Ziekten als gevolg van disfunctionele enzymen
- Enzymen: gebruik bij diagnostiek
- Enzymen en behandeling
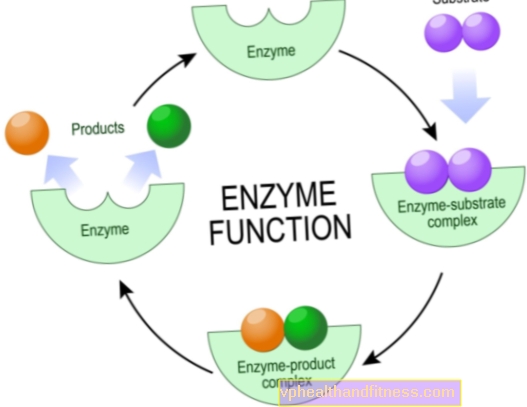
Enzymen zijn eiwitmoleculen die verschillende chemische reacties in levende organismen, waaronder het menselijk lichaam, versnellen of zelfs laten plaatsvinden.
Chemisch gezien zijn dit katalysatoren, d.w.z. deeltjes die de reactie intensiveren, maar niet slijten tijdens de reactie. Deze toename van de efficiëntie van chemische omzettingen is vaak enorm, natuurlijke katalysatoren kunnen de reactietijd verkorten van enkele jaren tot enkele seconden.
Enzymen worden in alle delen van het lichaam aangetroffen: in cellen, in de extracellulaire ruimte, in weefsels, in organen en in hun licht. De katalysator die een bepaald weefsel produceert, bepaalt de specifieke eigenschappen en de rol die het in het lichaam speelt.
De meeste enzymen zijn erg specifiek, wat betekent dat elk van hen verantwoordelijk is voor slechts één type chemische reactie waarbij specifieke deeltjes - de substraten - betrokken zijn, en alleen zij kunnen een interactie aangaan met een bepaald enzym.
De activiteit van natuurlijke katalysatoren is afhankelijk van vele factoren: de reactieomgeving, bijv. Temperatuur, pH, de aanwezigheid van bepaalde ionen, activatoren - ze versterken de werking van enzymen en remmers die deze activiteit tegengaan.
Enzymen: structuur
Zoals gezegd zijn de meeste enzymen eiwitten, ze hebben een zeer diverse structuur: van enkele tientallen aminozuren tot enkele duizenden, gerangschikt in een diverse ruimtelijke structuur.
Het is de vorm van hun vorming (de zogenaamde quaternaire structuur) en het feit dat de meeste enzymen veel groter zijn dan de reactanten van hun reacties, is grotendeels verantwoordelijk voor hun activiteit.
Dit komt door het feit dat slechts een bepaald gebied in de structuur van enzymen de zogenaamde actieve plaats is, d.w.z. het fragment dat verantwoordelijk is voor het uitvoeren van de reactie.
De taak van de resterende fragmenten van het molecuul is om een specifiek substraat te hechten, minder vaak andere verbindingen die de activiteit van het enzym beïnvloeden.
Het is de moeite waard om te weten dat de structuur van de katalysator zo is ontworpen dat het verbindingssubstraat ideaal is afgestemd op een "sleutel tot het slot".
Zoals alle eiwitten worden in de ribosomen enzymen geproduceerd uit het genetisch materiaal dat dicht opeengepakt zit in de kern - DNA, waardoor een zogenaamde primaire structuur ontstaat.
Daarna ondergaat het verschillende keren vouwen - het verandert van vorm, soms voegt het suikers, metaalionen of vetresten toe.
Het resultaat van al deze processen is de vorming van een actieve quaternaire structuur, d.w.z. een volledig biologisch actieve vorm.
In veel gevallen combineren verschillende enzymdeeltjes om een reeks chemische reacties uit te voeren en zo het proces te versnellen.
Het komt voor dat er in verschillende weefsels enzymen zijn die dezelfde reactie katalyseren, maar structureel niet op elkaar lijken, we noemen ze iso-enzymen.
De namen van de iso-enzymen zijn hetzelfde, ondanks het verschil in locatie en structuur, maar deze verschillen hebben praktische toepassing. Dankzij dit is het mogelijk om in laboratoriumtests alleen die enzymfracties te bepalen die afkomstig zijn van een specifiek orgaan.
De werkingsmechanismen van enzymen zijn divers, maar vanuit chemisch oogpunt is het hun taak altijd om de activeringsenergie van de reactie te verminderen. Dit is de hoeveelheid energie die de substraten moeten hebben om het proces te laten plaatsvinden.
Dit effect kan worden bereikt door een geschikte omgeving te creëren om de reactie uit te voeren, een andere chemische route te gebruiken om dezelfde producten te verkrijgen, of een geschikte ruimtelijke ordening van de substraten.
Elk van deze mechanismen kan worden gebruikt door enzymen.
Regulatie van enzymactiviteit
De werking van enzymen is afhankelijk van omgevingsparameters: temperatuur, pH en andere. Elk van de natuurlijke katalysatoren heeft zijn eigen optimale prestatie onder bepaalde omstandigheden, die sterk kunnen verschillen afhankelijk van de tolerantie voor omgevingsomstandigheden.
Bij temperatuur verlopen de meeste enzymatische reacties sneller bij hogere temperaturen, maar bij een bepaalde temperatuur neemt de reactie-efficiëntie sterk af, wat wordt veroorzaakt door thermische schade aan het enzym (denaturatie).
In termen van hun structuur kunnen hormonen in twee groepen worden verdeeld:
- eenvoudig - dit zijn slechts eiwitdeeltjes
- complex - waarvoor de hechting van een niet-eiwitgroep vereist is - een cofactor voor hun activiteit
Deze laatste spelen een sleutelrol bij de juiste activiteit en regulering van enzymen.
Op hun beurt kunnen cofactoren worden onderverdeeld in twee groepen: die nodig zijn voor het functioneren van het enzym, sterk ermee geassocieerd - dit zijn de zogenaamde prothetische groepen, het kunnen metalen zijn, organische moleculen, zoals heem.
De tweede groep zijn co-enzymen, ze zijn meestal verantwoordelijk voor de overdracht van substraten of elektronen, en hun binding aan het enzym is zwak, deze groep omvat bijvoorbeeld foliumzuur, co-enzym A. Het is de moeite waard om te weten dat veel vitamines als co-factoren werken.
Remmers vervullen een heel andere taak, het zijn deeltjes die enzymatische activiteit remmen door zich aan het enzym te binden.
Er zijn verschillende soorten remmers:
- onomkeerbaar - ze veroorzaken permanente inactivering van het molecuul en de reactie kan alleen plaatsvinden na de productie van een nieuw enzym
- competitief - in dit geval heeft de remmer een structuur die lijkt op het substraat, dus strijden ze om de actieve site. Als een remmer is aangebracht, mislukt de reactie zolang het substraat normaal is
- niet-competitief - dergelijke remmers binden het enzym op een andere plaats dan het substraat hecht, zodat het zich aan het enzym kan hechten, maar de reactie vindt niet plaats
Bij een veel hogere concentratie van het substraat dan de remmer, wordt het effect van de competitieve remmer overwonnen omdat het de "competitie" om de actieve site ontgroeit, in het geval van niet-competitief kan het effect ervan niet worden overwonnen door de concentratie van het substraat te verhogen.
Naast regulering van de activator- en remmersystemen zijn er vele andere methoden om de enzymactiviteit te beheersen.
Ze hebben betrekking op de controle van de productie door de cel op het niveau van de eiwitvorming, evenals de regulering van de zogenaamde posttranslationele verwerking, d.w.z. veranderingen in de structuur van een eiwitmolecuul die onmiddellijk optreden na de synthese ervan in het ribosoom. Deze modificaties zijn bijvoorbeeld het verkorten van de polypeptideketen.
Andere reguleringsmethoden hebben betrekking op de segregatie en plaatsing van enzymen in geschikte gebieden: cellulair en in specifieke organellen, of in het extracellulaire compartiment.
Er is nog een ander belangrijk reguleringsmechanisme - negatieve feedback - het is het primaire controlesysteem in het endocriene systeem. Het werkt volgens het principe van remming.
Dit betekent dat als een enzym te veel van een bepaald hormoon aanmaakt, het zich eraan bindt, waardoor de activiteit wordt geremd en de synthese wordt verminderd, dus het reactieproduct zelf remt de productie ervan.
Enzymen: rol
Elk weefsel van het menselijk lichaam produceert een specifieke set enzymen, die de rol van deze cellen in het functioneren van het lichaam bepalen. Wat zijn deze enzymen wordt bepaald door de genetische code en welke regio's zijn actief in een bepaalde cel.
Duizenden chemische reacties vinden op elk moment in het menselijk lichaam plaats, die elk een specifiek enzym vereisen, dus het zou moeilijk zijn om al deze deeltjes in ons lichaam op te sommen.
Het is echter de moeite waard om enkele van de meest karakteristieke zaken te kennen:
- Spijsverteringsenzymen - geproduceerd door de weefsels van het spijsverteringsstelsel, ze breken voedsel af in eenvoudige verbindingen, omdat alleen deze in het bloed kunnen worden opgenomen. Het zijn extracellulaire enzymen, dus ze vervullen hun hoofdtaak buiten de cellen waarin ze worden geproduceerd. Sommige van deze enzymen worden gevormd in een inactieve vorm, zogenaamde pro-enzymen of zymogenen, en worden geactiveerd in het maagdarmkanaal. De spijsverteringsenzymen omvatten bijvoorbeeld amylase, lipase, trypsine.
- Myosine is een enzym dat in de spieren wordt aangetroffen, het breekt ATP-moleculen af die energiedragers zijn, waardoor het ervoor zorgt dat de spiervezels samentrekken.
- Peroxidasen zijn oxiderende enzymen en katalasen, d.w.z. reducerende enzymen
- Acetylcholinesterase is een enzym dat acetylcholine afbreekt, een van de boodschappers in het zenuwstelsel
- Monoamineoxidase is het meest voorkomende enzym in de lever en is verantwoordelijk voor de afbraak van adrenaline, norepinefrine en sommige medicijnen
- Cytochoomoxidase, een zeer belangrijk intracellulair enzym dat verantwoordelijk is voor energieveranderingen
- Lysozym, een stof die bijvoorbeeld in tranen of speeksel aanwezig is en beschermende functies vervult, vernietigt ziekteverwekkers
- Alcoholdehydrogenase, een enzym in de lever dat verantwoordelijk is voor het afbreken van ethanol
- Alkalische fosfatase, neemt deel aan botopbouw door osteoblasten
Enzymen: nomenclatuur
Enzymnamen zijn vaak vrij gecompliceerd omdat ze zijn afgeleid van de naam van de reactie die ze uitvoeren en het substraat dat bij de reactie is betrokken, bijvoorbeeld 5-hydroxytryptofaan decarboxylase.
Typisch wordt het achtervoegsel "-aza" toegevoegd aan de algemene naam van de reactie, en het tweede deel van de enzymnaam wordt gevormd door de naam van de verbinding die deze reactie ondergaat.
Het komt voor dat de naam enkelvoudig is, dan komt hij van een substraat, bijvoorbeeld lactase (enzym dat lactose afbreekt).
Meer zelden zijn de namen van enzymen afgeleid van een algemeen proces dat plaatsvindt met hun deelname, bijvoorbeeld DNA-gyrase, d.w.z. het enzym dat verantwoordelijk is voor roterende DNA-strengen.
Sommige enzymen hebben uiteindelijk gewone namen of namen die door hun ontdekker zijn gegeven, zoals pepsine (dat eiwitten afbreekt in het spijsverteringskanaal) of lysozym (een bacteriedodend enzym in tranen).
Er is ook een kleine groep restrictie-enzymen die verantwoordelijk zijn voor het knippen van DNA-strengen, in dit geval komt de naam van het micro-organisme waaruit het enzym is geïsoleerd.
De International Union of Biochemistry and Molecular Biology introduceerde de regels voor het benoemen van enzymen en verdeelde ze in verschillende klassen om de nomenclatuur te standaardiseren.
Het vervangt de eerder beschreven namen niet, het is eerder een supplement dat voornamelijk door wetenschappers wordt gebruikt.
Volgens de regels van de Europese Unie wordt elk enzym beschreven door een reeks karakters: EC x.xx.xx.xx - waarbij het eerste cijfer staat voor de klasse, de daaropvolgende subklassen en subklassen, en tenslotte het enzymnummer. De genoemde enzymklassen zijn:
• 1 - oxidoreductases: katalyseren oxidatie- en reductiereacties
• 2 - transferases: overdracht van functionele groepen (bijv. Fosfaat)
• 3 - hydrolasen: komen overeen met de hydrolyse (ontleding) van bindingen
• 4 - lyases: verbreken de bindingen door een ander mechanisme dan hydrolyse
• 5 - isomerasen: ze zijn verantwoordelijk voor de ruimtelijke veranderingen van moleculen
• 6 - ligasen: verbind moleculen met covalente bindingen
Enzymen en medicijnen
Het belang van enzymen voor de menselijke gezondheid is enorm. De goede werking ervan maakt een gezond leven mogelijk en dankzij de ontwikkeling van analytische apparaten hebben we geleerd om verschillende ziekten te diagnosticeren door middel van enzymbepaling. Bovendien zijn we in staat om de tekorten van sommige enzymen en de daaruit voortvloeiende ziekten met succes te behandelen, maar helaas is er op dit gebied nog veel te doen.
Behandeling van de oorzaken van stofwisselingsziekten is momenteel niet mogelijk, omdat we het genetisch materiaal niet veilig en effectief kunnen aanpassen om beschadigde genen en dus verkeerd geproduceerde enzymen te herstellen.
Ziekten als gevolg van disfunctionele enzymen
De goede werking van ons lichaam hangt grotendeels af van de goede werking van enzymen. In veel gevallen hebben ziektetoestanden invloed op de hoeveelheid enzymen, waardoor ze overmatig uit cellen worden afgegeven of juist een tekort hebben.De volgende zijn slechts voorbeelden van ziekten die worden veroorzaakt door abnormale enzymatische functies, er zijn er nog veel meer.
- Metabole blokkades of stofwisselingsziekten
Metabole blokkades of stofwisselingsziekten zijn een groep erfelijke ziekten die worden veroorzaakt door de ophoping van stoffen in de cel door het ontbreken van een enzym dat verantwoordelijk is voor hun metabolisme. Er zijn in de loop van de tijd zoveel substraten verzameld dat ze giftig worden voor cellen en het hele organisme.
Er zijn enkele duizenden van deze ziekten, hun aantal weerspiegelt de veelheid aan enzymen die in het menselijk lichaam worden aangetroffen, aangezien stofwisselingsziekten de meeste genen kunnen aantasten die enzymen coderen.
Voorbeelden zijn galactosemie of homocystinurie, zeldzame ziekten die zich meestal direct na de geboorte of in de eerste levensjaren manifesteren.
- Tumoren
Een andere groep ziekten waarbij een enzymstoring een rol kan spelen, is kanker. Naast vele andere functies zijn enzymen ook verantwoordelijk voor het reguleren van celdeling, de zogenaamde tyrosinekinasen. Als deze enzymen op dit gebied falen, kan ongecontroleerde celdeling en dus een neoplastisch proces optreden.
- Emfyseem
Een minder vaak voorkomende ziekte is emfyseem, in welk geval elastase overactief wordt. Het is een enzym dat aanwezig is in het longweefsel en verantwoordelijk is voor de afbraak van onder andere het elastine-eiwit in de longen.
Als het te actief is, wordt de balans tussen vernietiging en opbouw verstoord, ontstaat er littekenvorming en ontstaat emfyseem.
Enzymen: gebruik bij diagnostiek
Moderne medische diagnostiek is gebaseerd op het gebruik van enzymen bij hun bepalingen. Dit is te wijten aan het feit dat ziektetoestanden direct of indirect leiden tot een onbalans van enzymen, waardoor hun hoeveelheid in het bloed toeneemt of daalt.
Dit kan niet alleen het gevolg zijn van productiestoornissen, maar bijvoorbeeld ook van het vrijkomen van een grote hoeveelheid intracellulair enzym in het bloed of de urine als gevolg van schade aan het celmembraan.
Voorbeelden van enzymen die in laboratoriumtests worden gebruikt, zijn:
- Creatinekinase - een enzym dat aanwezig is in spieren, ook in de hartspier, de meervoudige toename kan wijzen op een hartaanval, myocarditis, spierziekten - verwondingen, dystrofie.
- Lactaatdehydrogenase - aanwezig in alle cellen van het lichaam, vooral in de hersenen, longen, witte bloedcellen en spieren. De grote toename wordt waargenomen bij myocardinfarct, spier- en leveraandoeningen of kanker.
- Alkalische fosfatase komt vooral voor in de lever en botten, hier wordt het vrijgegeven door osteoblasten. Ziekten van deze organen kunnen de groei veroorzaken, maar de overmaat aan alkalische fosfatase kan ook wijzen op het regeneratieproces van de botten - na een operatie of breuk.
- Zure fosfatase komt voor in veel organen - lever, nieren, botten, prostaat; vanuit diagnostisch oogpunt kan de toename ervan duiden op bot- en prostaataandoeningen.
- Aspartaataminotransferase en alanine-aminotransferase - dit zijn enzymen die kenmerkend zijn voor de lever, die bijna uitsluitend in hepatocyten voorkomen, ze worden gebruikt bij de basisdiagnose van leveraandoeningen en hun meervoudige toename van hun waarden leidt altijd tot een verdere diagnose van leveraandoeningen.
- Glutamaatdehydrogenase en gammaglutamyltransferase - andere leverenzymen, vergelijkbaar met de eerder genoemde, zijn belangrijk bij de diagnose van ziekten van dit orgaan en de galwegen.
- Amylase is een enzym dat in veel organen aanwezig is, maar de hoogste concentratie wordt bereikt in de cellen van de pancreas en speekselklieren, de diagnose is van het grootste belang bij hun ziekten.
- Lipase is een ander pancreasenzym, het verschilt in specificiteit van amylase, wat betekent dat lipase alleen in de pancreas voorkomt en afwijkingen van de norm bij de bepaling van dit enzym duiden op pancreasziekte.
- Cholinesterase is een enzym dat acetylcholine afbreekt - een zender in het zenuwstelsel, waar het ook in de hoogste hoeveelheid aanwezig is, in diagnostiek wordt het gebruikt bij vergiftiging met organofosforverbindingen.
- Coagulatie- en fibrinolysefactoren - dit zijn stoffen die door de lever worden geproduceerd en die betrokken zijn bij de bloedstolling, hun bepalingen zijn niet alleen belangrijk bij de beoordeling van dit proces, maar ook bij het bewaken van de leverfunctie.
- Alfa-fetoproteïne - een leverenzym, waarvan de hoeveelheid toeneemt bij ziekten van dit orgaan, waaronder kanker.
- C-reactief proteïne - geproduceerd door de lever, neemt deel aan de immuunrespons, de hoeveelheid neemt toe in het bloed bij ontstekingsaandoeningen - infecties, verwondingen, auto-immuunziekten.
- Ceruloplasmine - een ander leverenzym, waarvan een toename kenmerkend is voor de ziekte van Wilson.
- Pyridinoline en deoxypyridinoline zijn markers van botresorptie (vernietiging) en karakteriseren de functie van osteoclasten (osteogene cellen).
- Myoglobine - zoals eerder vermeld, is dit een samengestelde eigenschap van spieren, dus de toename ervan duidt op schade aan de skelet- of hartspieren.
- Troponinen - de zogenaamde hartaanvalmarkers, zijn enzymen die de samentrekking van spiervezels reguleren, ze zijn vooral overvloedig aanwezig in de hartspier. De schade veroorzaakt de afgifte van grote hoeveelheden troponinen in het bloed, die worden gebruikt bij de diagnose van hartaandoeningen. Het is echter de moeite waard eraan te denken dat een toename van troponines niet alleen kan wijzen op een hartaanval, maar ook op insufficiëntie, klepdefecten of longembolie.
Alle hierboven genoemde enzymen kunnen in verschillende groepen worden ingedeeld:
- Secretoire enzymen - de ondergrens van de norm is diagnostisch. Dit zijn enzymen die fysiologisch door organen worden aangemaakt, maar bij ziekten neemt hun aantal af, bijvoorbeeld stollingsfactoren
- Indicator-enzymen - groei is belangrijk. Deze groep enzymen verschijnt in grote hoeveelheden als gevolg van orgaanschade en lekkage van enzymen, waaronder troponinen
- excretie-enzymen - dit zijn enzymen die normaal in het lumen van verschillende organen worden geproduceerd - de mond, darmen of urinewegen. Als hun uitlaat geblokkeerd is, komen ze in het bloed terecht, bijvoorbeeld amylase
Het is de moeite waard eraan te denken dat enzymen worden gebruikt in de medische diagnostiek zelf. Biochemische analyses worden uitgevoerd met behulp van enzymen, en een juiste interpretatie van de resultaten van enzymatische reacties maakt het mogelijk om het resultaat van een laboratoriumtest te leveren.
Enzymen en behandeling
Veel medicijnen werken door de werking van enzymen te beïnvloeden, ofwel door ze te laten werken, ofwel door remmers te zijn. Er zijn enzymvervangers zoals pancreatine die lipase en amylase bevatten voor pancreasinsufficiëntie.
Aan de andere kant remmen sommige groepen geneesmiddelen de werking van enzymen, bijvoorbeeld remmers van angiotensineconversie-enzymen die onder andere worden gebruikt bij hypertensie en hartfalen, of sommige antibiotica, zoals amoxicilline, dat het enzym bacteriële transpeptidase remt, dat de opbouw van de bacteriële celwand verhindert, en dus remt. infectie.
Sommige gifstoffen werken ook door enzymen te beïnvloeden. Cyanide is een krachtige remmer van cytochroomoxidase, een essentieel onderdeel van de ademhalingsketen. Door het te blokkeren, kan de cel geen energie verkrijgen, wat tot zijn dood leidt.
Voor een goed verloop van de levensprocessen van cellen is het noodzakelijk dat er veel chemische stoffen aanwezig zijn, die onderling in strikte verhoudingen blijven en waartussen voortdurend chemische reacties plaatsvinden.
Deze taak wordt uitgevoerd door goed functionerende enzymen, die nodig zijn om bijna elke chemische reactie te laten plaatsvinden met de snelheid en efficiëntie die nodig zijn voor het goed functioneren van het menselijk lichaam.
De werking van enzymen versnelt deze processen vele malen, vaak zelfs honderden keren, wat belangrijk is, de enzymen zelf slijten niet tijdens de reacties die plaatsvinden.
Het ontbreken van katalysatoren of hun onjuiste werking kan leiden tot het ontstaan van vele ziekten. Aan de andere kant stelt een bekwame aanpassing van hun activiteit u in staat om veel aandoeningen met succes te behandelen.
Enzymologie (de wetenschap van enzymen) is buitengewoon uitgebreid en de ontwikkeling ervan kan niet alleen wetenschappelijke vooruitgang opleveren, maar ook actief bijdragen aan de ontwikkeling van de geneeskunde op het gebied van niet alleen behandeling, maar ook diagnostiek.
Over de auteur























---badanie-wydolnoci-y-i-ttnic.jpg)
